УЗБЕКСКОЕ АГЕНТСТВО ПОЧТЫ И ТЕЛЕКОММУНИКАЦИЙ
ТАШКЕНТСКИЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ ИНСТИТУТ СВЯЗИ
А.М. АБДУЛЛАЕВ, Х.К. АРИПОВ, З.Е. АГАБЕКОВА, Г.Н.КУЗЬМИНА, Е.В. ОБЪЕДКОВ
кафедра электронных и квантовых приборов
ХИМИЯ
Конспект лекций
для бакалавров по направлению
В 522300 - Телекоммуникации (РРТ, ТСП, ТС и СК)
В 163600 - Педагог по телекоммуникации
В 522600 - Информатика и информационные технологии
В 840500 - Почтовая служба
В 341100 - Менеджмент
В 522500 - Радиотехника
Часть 1
Ташкент - 2001
А.М.Абдуллаев, X.К.Арипов, 3.Б.Агабекова, Г.Н.Кузьмина,
Е.В. Объедков. Химия. Конспект лекций-Ташкент : ТЭИС, 2001
40с. Часть1. План 1999 г, п. 16,4.
В конспекте лекций обобщён и систематизирован материал по неорганической химии. Отличительной особенностью конспекта является наличие концептуальных диаграмм, соответствующих содержанию изучаемых тем. Они должны помочь присамостоятельном изучении курса.
Конспект лекций предназначен для бакалавров соответствующих направлений и профилей.
Ответственный редактор: д.ф-м.н,.проф. Арипов Х.К.
Рецензенты:
д.х.н.,проф. Ахмеров К.
к.х.н. Алиева М.
© Издание Ташкентского электротехнического института связи, 2001
Оглавление
Тема 1. Цель и задачи курса «Химия». Основные понятия
Тема 2. Закономерности протекания химических процессов
Тема 3. Растворы и электролиты
Тема 4. Неорганические соединения
Тема 5. Строение атома. Периодический закон и строение атома
Тема 6. Химическая связь
Тема 7. Окислительно-восстановительные реакции
Тема 8. Металлы
Литература
Тема 1. Цель и задачи курса "Химия". Основные понятия.
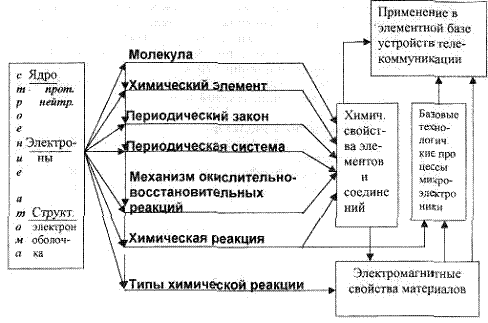
1.1.Концептуальная диаграмма структуры курса и его места в подготовке бакалавров телекоммуникации.
1.2. Основные понятия и законы химии.
Основой химической науки являются атомно-молекулярное учение, закон сохранения, периодический закон и теория химического строения.
Основные положения атомно-молекулярной теории заключаются в следующем:
 |
1. Вещества состоят из молекул; молекулы отличаются химическим составом, размерами, физическими и химическими свойствами.
2. Молекулы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость движения молекул зависит от агрегатного состояния веществ.
3. При химических явлениях молекулы претерпевают качественные и количественные изменения и из одних молекул образуются другие.
4. Молекулы состоят из атомов, атомы характеризуются размерами и массой. Свойства атомов одного и того же элемента одинаковы и отличаются от свойств других элементов. При химических реакциях атомы в отличие от молекул, не претерпевают качественных изменении. Молекула как единое целое характеризуются новой совокупностью свойств. Молекула состоит из одинаковых или различных атомов, соединенных в одно целое химическими связями. Если вещество образовано одинаковыми атомами, то его называют простым,, если же различными, то сложным.
Атом состоит из положительно заряженного ядра и движущихся вокруг ядра электронов. В атоме их ровно столько, сколько протонов в ядре.
Свойства атома определяются зарядом его ядра. Ядро составляют тяжелые по сравнению с электроном частицы: протоны и нейтроны. Протоны и нейтроны являются нуклонами. Материалом, связывающим нуклоны внутри ядра, служат пи-мезоны, которыми нуклоны обмениваются.
Определенный вид атомов, характеризующийся одинаковым положительным зарядом ядра называется химическим элементом.
Состав веществ условно обозначают химическими формулами, в которых символами указывают химические элементы, а цифровыми индексами - число атомов каждого элемента.
Важной характеристикой атома является его масса- Истинная масса атома элемента называется абсолютной атомной массой. Но этой величиной выраженной в граммах или килограммах пользоваться затруднительно. Поэтому при вычислении атомных масс за единицу массы принимают 1/12 массы атома изотопа углерода с массовым числом 12. Эта единица измерения атомной массы называется углеродной единицей массы (у.е-м.) или атомной единицей массы (а.е.м,): 1 а.е.м= 1,667 10' кг. Масса атома, выражаемая в атомных единицах массы, называется относительной атомной массой.
Абсолютной молекулярной массой называется истинная масса молекулы. Относительной молекулярной массой называется масса молекулы, выраженная в атомных единицах массы.
За единицу количества вещества в химии принят моль или количество вещества, которое содержит 6,02 1023 атомов. Число атомов в 1 моле вещества постоянно и оно называется постоянной Авогадро.
Масса 6,02 10 молекул равна числу молекул, умноженному на относительную молекулярную массу одной молекулы в атомных единицах массы в граммах. Такая единица количества вещества называется молем.
Массу одного моля данного вещества называют его молярной массой М.
1.3. Закон сохранения массы.
Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции,
1.4. Закон постоянства состава.
Каждое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
1.5. Закон эквивалентов.
Химические вещества соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
Эквивалентом химического элемента называют такую его массу, которая соединяется с 1,008 частей массы (ч.м.) водорода или 8 ч.м, кислорода или замещает эти массы в соединениях.
Один и тот же элемент может иметь не один, а несколько эквивалентов.
Эквивалентом сложного соединения называют массу этого соединения, содержащую эквивалент кислорода (кислоты) или эквивалент металлической составной части (основания, соли).
1.6. Закон кратных отношений.
Если два элемента образуют друг с другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
1.7. Закон объёмных отношений и закон Авогадро.
Объемы вступающих в реакцию газов относятся друг к другу, а также к объему получающихся газообразных продуктов как простые целые числа.
1.8. Закон периодичности.
Свойства простых тел, а также форма и свойства соединений находятся в периодической зависимости от величины атомных весов элементов.
Тема 2. Закономерности протекания химических процессов.
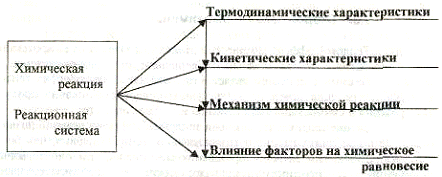 |
Концептуальная диаграмма
2.1. Тепловые эффекты химических реакций.
Одним из признаков химической реакции является выделение или поглощение тепло ты, происходящее при химических превращениях одних веществ в другие.
Реакции, протекающие с выделением теплоты, носят название экзотермических реакций, а сопровождающиеся поглощением теплоты-эндотермических. К первым относятся, как правило, все реакции соединения, а типичными реакциями второго типа являются реакции разложения.
Количество теплоты, выделяющейся или поглощающейся при химической реакции, называется тепловым эффектом реакции. Обычно его выражают в килоджоулях (кДж).
Уравнения химических реакций, в которых приводятся значения тепловых эффектов, называются термохимическими. Знак "+" или "-", перед значением теплового эффекта в правой части уравнения показывает - выделяется или поглощается теплота.
2.2. Первый закон термохимии.
Тепловой эффект прямой реакции равен по абсолютному значению и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект реакции образования одного моля химического соединения из простых веществ, устойчивых при данных условиях, называется теплотой образования.
Поскольку значения тепловых эффектов относят к состоянию исходных продуктов, называемого стандартным, т.е. при температуре 298 К (25°С) и давлении 105 Па, то теплота образования обозначается (Q0298)
2.3. Второй закон термохимии.
Тепловой эффект химической реакции не зависит от её протекания и определяется только начальным и конечным состояниями системы,
Важным следствием является правило, согласно которому тепловой эффект реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ,
Знание теплот образования и тепловых эффектов реакций позволяет делать приближенные, но очень важные выводы. Во-первых, чем больше экзотермический эффект образования соединения, тем оно термически устойчивее. Во-вторых, эндотермические и слабоэкзотермические соединения являются, как правило, химически малоустойчивыми и обладают более высокой реакционной способностью, чем сильно экзотермические вещества.
Наконец, необходимо подчеркнуть, что значения тепловых эффектов реакций образования химических соединений, как и другие свойства, находятся в периодической зависимости от атомных номеров элементов, образующих эти химические соединения.
2.4. Реакционная система.
Химический процесс можно изобразить следующим образом:
исходные вещества → конечные продукты
Характер взаимодействия существенно зависит от агрегатного состояния реагентов (исходных веществ) и продуктов. Реагенты и продукты, вместе взятые, образуют так называемую физико-химическую систему. Совокупность однородных частей системы, обладающих одинаковым химическим составом и свойствами и отделенных от остальных частей системы поверхностью раздела, называют фазой.
Системы, состоящие из одной фазы. называются гомогенными, а системы, содержащие несколько фаз, - гетерогенными. Соответственно этому различают гомогенные и гетерогенные реакции. Реакция гомогенная, если реагенты и продукты составляют одну фазу (для обратимых реакций). Для необратимых химических реакций гомогенной называется реакция, когда только реагенты составляют единую фазу.
При гетерогенной реакции реагенты и продукты находятся в различных фазах.
Гетерогенные реакции в зависимости от систем, в которых они реализуются, бывают следующих основных типов: газ-жидкость; газ-твердое; жидкость-твердое,
Реакции, где одной из реагирующих фаз является твердое вещество, называются топохимическими, так как в этом случае участки, где протекает реакция (реакционные зоны) строго зафиксированы.
Механизм гетерогенных реакций существенно отличается от механизма гомогенных реакций прежде всего тем, что последние протекают по всему объему реакционной смеси, в то время как гетерогенные на межфазной поверхности (границе) раздела.
Этот специфический механизм гетерогенных реакций часто называют макрокинетическим механизмом, поскольку он рассматривает особенности протекания химической реакции в целой физико-химической системе, не затрагивая молекулярного уровня процесса.
Наиболее важными примерами гетерогенных реакций, имеющими практическое значение, являются реакции твердофазного взаимодействия двух или нескольких оксидов для получения материалов в современной технике (ферритов, сегнето и пьезокерамики и т. д.), многие реакции органических реагентов с водными растворами кислот и оснований, Обычно гетерогенные реакции завершаются значительно позже, чем гомогенные, что связано с "объемным" механизмом развития последних.
Микрокинетический молекулярный механизм реакций установить очень сложно.
Определение механизма химической реакции является специальной задачей химической кинетики.
2.5. Химическая кинетика
Химическая кинетика - один из важнейших разделов химии, задача которого - трактовка качественных и количественных изменений химического процесса происходящего во времени. Обычно эту общую задачу подразделяют на две конкретные:
1) выявление механизма реакции - установление элементарных стадий процесса и последовательности их протекания (качественные изменения);
2) количественное описание химической реакции - установление строгих соотношений, которые могли бы удовлетворительно предсказывать изменения количеств исходных реагентов и продуктов по мере протекания реакции.
2.6. Течение реакции
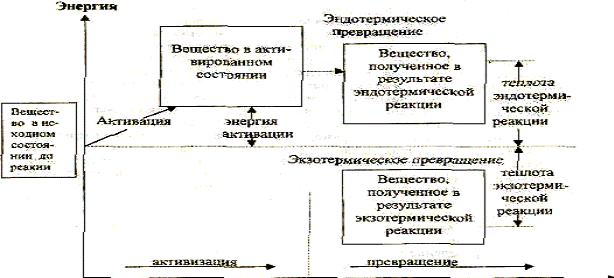 |
Взаимодействие частиц, сопровождающееся превращением вещества, делится на два этапа: активация и собственно превращение. Активация - сообщение частицам такого количества энергии, что при их эффективном соударении происходит разрыхление связей и образование веществ в активированном состоянии.Превращение - образование из веществ в активированном состоянии соединений в основном состоянии (продуктов реакции),
 |
Направление химической реакции
Энергия активации Е - это та энергия, которой должны обладать молекулы для эффективного взаимодействия. Сама энергия активации обусловлена энергетическим барьером, который следует преодолеть сталкивающимся молекулам в прямом (Е) или обратном (Е) направлениях, прежде чем произойдет перераспределение связей.
2.7. Скорость химической реакции
Основным понятием в химической кинетике является понятие о скорости реакции: скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени:
V=-(C2-C1) / (t2-t1) (2.1)
Скорость химической реакции зависит от многих факторов, включая природу реагентов, концентрацию реагирующих веществ и температуру, наличие катализаторов, состояние кристаллической решетки твердых реагентов и продуктов, если такие имеются в системе.
Влияние концентрации реагентов на скорость химической реакции выражается основным законом химической кинетики - законом действующих масс.
Скорость простой гомогенной химической реакции прямо пропорциональна произведению концентрации реагирующих веществ.
Кинетическое уравнение простой реакции аА + ЬВ= АВ равна
V = К СAa CBb (2.2),
где СA и СB - концентрации реагирующих веществ, а К - константа скорости реакции.
Зависимость скорости реакции от концентрации раствора, выражаемая основным законом химической кинетики, распространяется на газовые смеси и растворы, но она неприменима к реакциям с участием твердых фаз.
Скорость большинства химических реакций при повышении температуры растет, причем для реакции в гомогенных системах при нагревании на каждые десять градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа). Иначе говоря, при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогресии.
Одним из наиболее эффективных способов воздействия на скорость химической реакции является использование катализаторов или ингибиторов.
Катализатор - вещество, изменяющее скорость реакции, но остающееся к концу процесса неизменным как по составу так и по массе.
Явление ускорения химических реакций благодаря присутствию катализатора носит название катализа, а замедления - ингибирования.
2.8. Химическое равновесие
Если химическая реакция идет до конца, т.е. реагенты полностью превращаются в продукты реакции, то она называется необратимой.
Большинство химических процессов являются обратимыми и по мере их протекания в системе создаются условия для противоположных изменений.
Рано или поздно достигается состояние, при котором скорости прямой и обратной реакции сравняются. Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции называется химическим равновесием.
Концентрации реагентов и продуктов, отвечающие состоянию равновесия, называются равновесными и обозначаются символами:
[А], [В], [С] и [D] для реакции аА+ ЬВ - сС+ dD,
K1[A]a[B]b=K2[C]c[D]d,
Отношение констант скоростей прямой и обратной реакций является также постоянной величиной, получившей название константы химического равновесия.
Кр = K1 / К2 =[C]c[D]d/[A]a[B]b ) (2.3)
Это уравнение является математическим выражением закона действующих масс при химическом равновесии.
Изменения, происходящие в равновесной системе в результате внешних воздействии, определяются принципом подвижного равновесия, принципом Ле Шателье.
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
|
Изменение условий реакции |
Влияние на сдвиг положения равновесия. |
|
повышение Температура понижение
|
Увеличивает скорость эндотермической реакции.
Увеличивает скорость экзотермической реакции. |
|
повышение Давление понижение |
Увеличивает скорость реакции, протекающей с уменьшением объема.
Увеличивает скорость реакции. протекающей с увеличением объема. |
|
повышение Концентрация понижение |
Увеличивает скорость реакции, использующей вводимое вещество.
Увеличивает скорость реакции, протекающей с образованием вещества, концентрация которого снижается. |
Тема 3. Растворы и электролиты
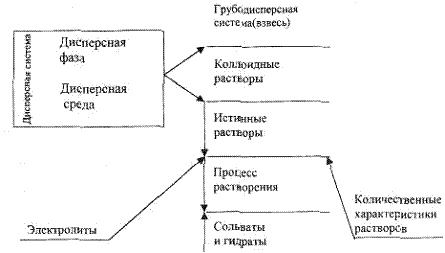 |
3.1. Концептуальная диаграмма.
3.2. Виды дисперсных систем
Если одно вещество равномерно распределено в другом веществе, то возникает дисперсная система. Распределенное вещество называется дисперсной фазой, а вещество, в котором распределена дисперсная фаза, -дисперсной средой. Дисперсные системы могут быть различными. По агрегатному состоянию их можно разделить на грубодисперсные (взвеси), коллоидные и истинные растворы.
|
Название |
Частицы |
Размеры частиц фазы |
Свойства |
|
Суспензии (твердая фаза) Эмульсии (жидкая фаза) |
макромолекулы или агрегаты молекул |
более 100 нм |
Суспензии можно фильтровать через бумажный фильтр. Не пропускают лучи света, быстро расслаиваются при хранении |
|
Коллоидные растворы |
макромолекулы или агрегаты молекул |
01 до 102 нм |
Более устойчивые при хранении |
|
Истинные Растворы |
молекулы или ионы |
не более 1 нм |
Устойчивые, прозрачные |
3.3. Сущность процесса растворения
Обязательными компонентами любого раствора являются растворитель и растворенное вещество. Растворителем обычно называют компонент, агрегатное состояние которого то же, что и у раствора в целом. В практике чаще пользуются растворами, в которых растворителя гораздо больше, чем растворенного вещества.
При растворении молекулы растворителя со всех сторон окружают частицы растворяемого вещества и под действием сил межмолекулярного притяжения, которые в конце концов преодолевают силы сцепления между частицами растворяемого вещества, отрывают их друг от друга. Вследствие диффузии частицы растворяемого вещества постепенно равномерно распределяются по всему объему раствора. Такова сущность процесса растворения в простейшем случае, если бы между растворителем и растворенным веществом не происходило химических процессов.
При растворении веществ происходит разрыв связей между ионами, атомами и молекулами, что связано с затратой энергии. Одновременно происходит взаимодействие частиц растворяемою вещества с растворителем, что сопровождается выделением энергии. Общий энергетический эффект зависит от соотношения выделяемой или поглощенной энергии. Тепловая энергия, выделяемая или поглощаемая при растворении веществ, называется теплотой растворения.
Выделение теплоты нельзя обяснить, если рассматривать растворение как простое смешивание. Объяснение этому дает гидратная теория растворов. Согласно этой теории, растворы представляют собой системы, состоящие не только из растворителя и растворенного вещества, но из продуктов их взаимодействия. Частицы растворенного вещества оказываются окруженными оболочками из молекул растворителя. Такая оболочка называется сольватной. Если растворителем является вода, то оболочка называется гидратиой.
Молекулы воды из гидратной оболочки иногда вступают в реакции с растворенным веществом, образуя химическое соединение, которые называются кристаллогидратами.
Процесс, протекающий при растворении вещества в воде, при котором происходит разрушение ионной кристаллической решетки, а полярные молекулы воды окружают катионы и анионы, уменьшая взаимодействие между ионами, называется гидратацией.
Процесс, при котором под влиянием полярных молекул воды образуются свободно движущиеся ионы, называется диссоциацией.
3.4. Количественные характеристики растворов
Растворимость твердых веществ и газов в воде небеспредельна; на растворимость влияют температура и давление и природа растворяемого вещества. Растворимость твердых веществ с повышением температуры увеличивается, газов - уменьшается. Повышение давления увеличивает растворимость газов.
Для, определения растворимости кислот, оснований и солей в воде существуют таблицы растворимости.
Важно не просто знать, растворимо вещество или нет, но и уметь расчитывать и готовить растворы со строго заданным содержанием в них растворенного вещества,
|
Название раствора |
Характеристики |
|
Разбавленный |
Содержит мало растворенного вещества |
|
Концентрированный |
Содержит много растворенного вещества |
|
Насыщенный |
Раствор, в котором при данной температуре данное вещество больше не растворяется |
Для более точного определения количественного состава раствора используется понятие концентрации.
Концентрацией С называется доля вещества, выраженная его массой, объемом или числом молей в массе, объеме или молярном количестве раствора или растворителя.
Массовая доля или массовой процент о- это отношение массы растворенного вещества m1 к общей массе раствора m, выраженное в процентах
w= (m1 /m) 100%
Объемный процент Соб - это отношение объема растворенного вещества и к общему объему раствора V, выраженные в процентах
Coб=(u/V)1OO%
Молярный процент Смол - отношение числа молей вещества п к числу молей смеси nсм
Cмол=n/nсм
При работе с растворами удобно пользоваться так называемыми нормальными концентрациями. Под нормальностью раствора понимают число грамм-эквивалентов вещества, растворенного в одном литре растворе. Если в 1 литре содержится 1.0 молекулярная масса вещества раствор называют однонормальным или просто нормальным.
Молярная -концентрация - количество молей растворяемого вещества, содержащегося в 1 дм3 (литре) раствора. Измеряется в моль/л.
Моляльная концентрация - количество молей вещества, растворенного в 1000 г. растворителя.
3.5. Электролиты
Водные растворы некоторых веществ проводят электрический ток, такие вещества называют электролитами. Вещества, растворы которых не проводят электрический ток, были названы не электролитами.
Механизм прохождения через раствор электрического тока можно объяснить с точки зрения теории электролитической диссоциации. Основные положения этой теории следующие:
1. Все электролиты под действием растворителя распадаются на положительно и отрицательно заряженные частицы-ионы.
2. Если через раствор пропускать постоянный электрический ток, то положительно заряженные ионы (катионы) будут двигаться к отрицательному полюсу-катоду, отрицательно заряженные ионы (анионы) будут перемещаться к положительному полюсу-аноду. Общий заряд катионов в растворе равен общему заряду анионов, поэтому раствор всегда бывает электронейтральный.
3. Ионы и атомы одних и тех же электролитов отличаются друг от друга по свойствам.
Электролитическая диссоциация - процесс обратимый, одновременно с образованием ионов идет противоположный процесс-связывание ионов в диссоцированные соединения.
О полноте диссоциации судят по степени диссоциации а.
Степень диссоциации а - это отношение числа диссоциированных частиц п к общему числу частиц N растворенного вещества, выраженное в процентах а = (n/ N) 100 %
Другими словами степень диссоциации показывает, какой процент молекул распался на ионы.
В зависимости от степени диссоциации различают сильные, средние и слабые электролиты.
|
Сильные электролиты |
Средние электролиты |
Слабые электролиты |
|
а >30% |
30% > а > 2% |
а < 2% |
Для количественного описания процессов распада и связывания ионов [АВ] А1 + В- , используют константу диссоциации или константу равновесия, которая выражается формулой:
К=[А+] [В-]/[А В]
 |
Тема 4 Неорганические соединения
4.1. Концептуальная диаграмма
4.2. Классификация неорганических соединений
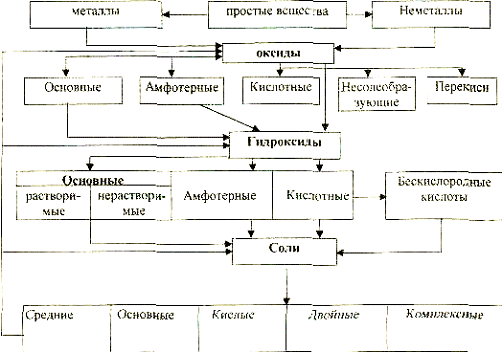
Неорганическая химия изучает химические элементы
и их соединения (кроме органических),
Все химические элементы традиционно делятся на металлы и неметаллы. К металлам относятся электроположительные элементы, способные сравнительно легко отдавать электроны, к неметаллам -электроотрицательные элементы, способные сравнительно легко присоединять электроны. Металлическое состояние характеризуется высокой электрической проводимостью, уменьшающейся с повышением температуры. В изолирующем (диэлектрическом) или полупроводниковом состоянии вещества имеют сравнительно низкую электрическую проводимость.
Неорганические соединения классифицируют по функциональному назначению и по составу. По функциональному признаку различают следующие типы: оксиды, гидроксиды, кислоты, соли.
Оксидами называются химические соединения, состоящие из двух элементов, один из которых кислород в степени окисления -2. Под степенью окисления понимают заряд атома в соединении, если бы все связи в этом соединении были ионные, а электроны смещены к наиболее отрицательному элементу,
Основаниями называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов ионов металла, а в качестве анионов - только гидрокcид-ионов.
Обычно основания называют гидроксидами, а гидроксиды металлов главной подгруппы 1 группы называют в некоторых случаях едкими щелочами.
Кислотами называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов только ионов водорода, а в качестве анионов - кислотного остатка.
Кислоты бывают кислородосодержащие и бескислородные. Кроме этого, кислоты классифицируются по основности: одноосновные, двухосновные, многоосновные.
Солями называются электролиты, диссоциирующие в водных растворах с образованием катиона металла и аниона кислотного остатка,
Комплексные соли имеют наиболее сложную структуру. В центре комплексного соединения находится центральный атом, который называется комплексообразователем. Вблизи комплекса расположены лиганды и адденды. Число легандов равно координационному числу комплексообразрователя. Координационное число определяет ряд факторов: размер атома, масса его ядра, строение электронной оболочки и др.
Вместе с центральным атомом лиганды образуют внутреннюю среду комплексов. Роль лигандов могут играть и нейтральные молекулы.
Вместе с центральным атомом лиганды образуют внешнюю сферу комплекса. Дальше от комплексообразователя может размещаться внешняя сфера. Суммарный заряд внешней сферы всегда равен по величине и противоположен по знаку суммарному заряду внутренней среды, формулу которой обычно заключают в скобки. В процессе диссоциации внутренняя сфера комплексной соли на ионы не распадается.
4.3. Номенклатура неорганических соединений
По номенклатурным правилам каждое вещество получает в соответствии с его формулой систематическое название, полностью отражающее его состав.
Общее правило - название соединения, состоящего из двух элементов, строится из названий каждого из них.
Первым называется элемент с большей электроотрицательностью, добавляя к латинской основе окончание - ид. Вторым называют (в родительном падеже) элемент с меньшей элекгроотрицательностью.
|
Название элемента |
Название элементов в соединении |
|
Фтор |
Фторид |
|
Хлор |
Хлорид |
|
Бром |
Бромид |
|
Кислород |
Оксид |
|
Сера |
Сульфид |
|
Азот |
Нитрид |
|
Углерод |
Карбид |
4.4. Химическая формула сложного вещества
Химическая формула сложного вещества включает в себя условно электроположительную составляющую или реальный катион и условно электроотрицательную составляющую или реальный анион. В формулах двухэлементных соединений из металлических и неметаллических элементов на первое место помещают металл.
Название сложного вещества согласно его формуле читается справа налево.
4.5. Взаимосвязь классов неорганических веществ
|
|
Неметалл || Кислотный || оксид |
Кислота |
Соль |
Вода |
|
|
Металл |
Соль, если О2-оксид |
|
Соль+ +водород |
Соль+ +металл |
Основание или основ-ной оксид + водород |
|
Основной оксид |
- |
Соль |
Соль+ +вода |
- |
Основание |
|
Основание |
- |
Соль+вода |
Соль+ +вода |
Соль+ основание |
- |
|
Соль |
- |
- |
Соль+ +кислота |
Соль+ соль |
Продукты гидролиза |
|
Вода |
- |
кислота |
- |
Продукты гидролиза |
- |
Тема 5 Строение атома. Периодический закон и строение атома.
5.1. Протоны, нейтроны и электроны в атоме
Атом является сложной системой, состоящей из положительно заряженного ядра и движущихся электронов, составляющих в совокупности его электронную оболочку,
Ядро атома состоит из протонов и нейтронов. Число протонов в ядре определяет величину положительного заряда ядра, чему соответствует порядковый номер элемента Z. Массовое число А отвечает суммарному числу протонов и нейтронов.
Природа элемента определяется числом протонов в ядре. Ядра всех атомов данного элемента имеют одно и то же число протонов, т.е. одинаковое значение Z. Разновидности элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов, т.е. характеризующиеся различными массовыми числами, но одинаковым порядковым номером, называются изогонами. С открытием изотопов было по-новому сформулированно понятие химического элемента. Химическим элементом называется вид атомов, обладающих одинаковым зарядом ядра.
Изотопы различных элементов с различными порядковыми номерами, но одинаковыми массовыми числами, называются изобарами. Изобары отличаются числом протонов и нейтронов в ядре, хотя общее число нуклонов у них одинаково. Изобары различны по своей химической природе.
5.2. Квантовая теория строения атома (теория атома Бора).
В основе теории строения атома лежат три постулата Бора.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные квантовые состояния, не изменяющиеся без внешних воздействий на атом.
В этих состояниях электрон, не излучая энергию, движется по круговым орбитам.
Второй постулат Бора (правило частот): при переходе атома из одною стационарного состояния в другое испускается или поглощается один фотон. Энергия фотона равна разности энергий атома в двух его стационарных состояниях:
hn=Em-En
Третий постулат Бора (правило квантования орбит): в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса (момента количества движения)
Ln = m vn rn = n ħ, n=1,2,3…
Здесь m-масса элетрона, rn- радиус n-ой орбиты,vn- скорость электрона на этой орбите, ħ=h/2p- главное квантовое число.
Квантовая механика внесла существенные уточнения в третий постулат Бора о квантовании момента импульса электрона в атоме.
Орбитальным квантовым числом l электрона в атоме называется целое число, определяющее возможные значения Li электрона
Орбитальное квантовое число 11 не совпадает с главным квантовым числом n. При заданом п орбитальное квантовое число может принимать следующие значения:
L=0,1,2…,(n-1)
Возможные значения Li в квантовой механики отличаются от квантованных значений Ln по постулату Бора тем, что вместо главного квантового числа n выражением для Ll входит
Различные значения l электрона являются в современной химии основой для систематики электронных состояний в атомах и молекулах. Приняты следующие обозначения : если l=0, то состояние электрона называется s- состоянием, если l=1, то состояние электрона называется р- состоянием, если l=2,3,… и т.д, то состояние электрона называется d-,f- и т.д. состояниями.
Вектор Li момента импульса электрона не может иметь произвольную ориентации в пространстве. Ориентация вектора Ll во внешнем магнитном поле с индукцией В характеризуется проекцией LlB вектора Ll на направление вектора В
![]()
Вектор Ll может иметь лишь такие ориентации в протранстве, при
которых проекция LlB принимала
бы целочисленные значения, кратные ħ=h/2p.
LlB = m ħ
Целое число m, определяющее возможные значения LlB называется магнитным квантовым числом. Оно может принимать следующие значения:
m=0,± 1,± 2,…± l
Для объяснения всей совокупности энергетических уровней водородоподобных атомов была введена гипотеза о наличии собственного вращения электрона. Величина момента количества движения собственного вращения называется спином. Спин электрона может иметь только две ориентации во внешнем магнитном поле. Проекции спина на направление индукции В внешнего магнитного поля могут принимать только два значения:
lsb= ± 1/2 ħ.
Если ввести магнитное спиновое число ms = ± 1/2, то
lsb = ms ħ.
Стационарное квантовое состояние электрона в атоме или молекуле характеризуется полным набором четырех квантовых чисел: n, l, m, ms. Каждое из них характеризует квантование: энергии (n), момента импульса (l), его проекции на направление внешнего магнитного поля (m) и проекции спина (ms).
Электроны и другие элементарные частицы, имеющие спин, равный ħ /2, подчиняются принципу Паули: в любой системе частиц со спином ħ /2 не может быть более одной частицы, находящейся в стационарном состоянии, определяемом данным полным набором четырех квантовых чисел.
Наибольшее число Z(n) электронов в атоме, которые находятся в состояниях, определяемых значением главного квантового числа п, Z(n) = 2n2.
Электроны в атоме занимающие совокупность состояний с одинаковыми значениями главного квантового числа п, образуют электронную оболочку, или электронный слой.
Различают следующие электронные оболочки (слои):
К - слой при n = 1,
L - слой при n = 2,
М - слой при n =- 3,
N - слой при n = 4,
О - слой при n = 5 и т.д.
В каждой электронной оболочке атома электроны распределяются по подгруппам или по подоболочкам. Подоболочка соответствует определенному значению орбитального квантового числа l. В таблице 1, вытекающей из принципа Паули приведены максимальные числа электронов в разных электронных слоях и подоболочках.
Таблица 1
|
n |
Электронный слой (оболочка) |
Количество электронов в состояниях |
Максимальное число электронов |
|||||
|
S (l=0) |
Р (l=1) |
D (l =2) |
f (l =3) |
g (l =4) |
||||
|
1 |
К |
2 |
- |
- |
- |
- |
2 |
|
|
2 |
L |
2 |
6 |
- |
- |
- |
8 |
|
|
3 |
М |
2 |
6 |
10 |
- |
- |
18 |
|
|
4 |
N |
2 |
6 |
10 |
14 |
- |
32 |
|
|
5 |
O |
2 |
6 |
10 |
14 |
18 |
50 |
|
5.2. Периодическая система элементов Менделеева
Периодической системой элементов Меделеева называется закон периодического изменения химических и физических свойств элементов в зависимости от их атомного номера Z. Через промежутки, называемые периодами в системе Менделеева, элементы, расположенные в одном вертикальном ряду (группе элементов), обнаруживают повторяемость физических и химических свойств.
Химические и физические свойства атомов химических элементов объясняются, главным образом, поведением электронов, расположенных во внешнем слое и внешней подоблочке атомов. Такие электроны называются валентными электронами. Периодичность свойств химических элементов связана с периодичностью в расположении валентных электронов атомов различных элементов данной группы.
Теория периодической системы элементов Менделеева основывается на четырех положениях:
а) общее число электронов в атоме данного химического элемента равно порядковому номеру Z этого элемента;
б) состояние элементов в атоме определяется полным набором четырех квантовых чисел: n, l, m, ms,
в) распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
г) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Заполнение электронами состояний в различных оболочках (слоях), а в пределах одной оболочки - в подгруппах (подоболочках) происходит в соответствии с требованием пункта в): сначала заполняют состояния с наименьшей возможной энергией, а затем состояния со все большей энергией. Для многих атомов этот порядок соответствует тому, что сначала заполняются оболочки с меньшим n, а затем оболочки с большим значением n. В пределах одной оболочки сначала заполняются состояния с l=0, а затем состояния с большими l, вплоть до l = n - 1. Заполнение оболочек и подоболочек по этому принципу должно соответствовать таблице 1.
В реальной периодической системе элементов Менделеева распределение электронов в атоме отличается от того, которое соответствует таблице 1. В результате взаимодействия между электронами при квантовых числах n = 3, 4,... состояние с большим n и малым / имеет меньшую энергию и является более выгодными энергетически, чем состояния с меньшим n, но с большим l Нарушения "идеального" заполнения состояний начинаются с калия (Z=19). Девятнадцатый электрон калия должен был бы занять состояние в М -оболочке при l = 3 и n = 2. Но химические свойства калия аналогичны свойствам лития и натрия, у которых валентный электрон занимает состояния соответственно n = 2, 1-0 и n = 3, 1-0. Поэтому и у калия его валентный девятнадцатый электрон должен находиться в s - состоянии (l = 0), Он занимает это состояние в следующей N - облочке (М =4). От калия (Z=19) до скандия (Z=21) при незаполненной d -оболочке (l = 2) в М-слое начинается "застройка" N - оболочки. Начиная со скандия, возобновляется заполнение подоболочки d в слое М, которое заканчивается у меди (Z = 29). Далее до криптона (Z=36) происходит нормальное заполнение N - оболочки.
В настоящее время периодическая система элементов Менделеева содержит химические элементы с атомными номерами от Z=1 (водород) до Z = 104 (курчатовий). Химические элементы с атомными номерами Z=105, Z=106, Z-I07 окончательно не названы.
Тема 6. Химическая связь
6.1. Концептуальная диаграмма
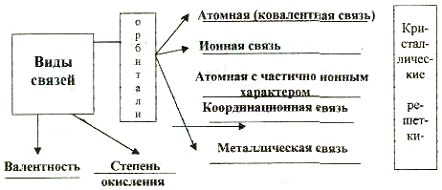
6.2. Основные понятия.
Атомная (ковалентная) связь - химическая связь, созданная общей электронной парой (перекрывание орбиталей). Может образоваться как между одинаковыми, так и между различными атомами, харакгерна преимущественно для неметаллов. Вещества, имеющие атомную связь, часто построены из молекул, имеют молекулярную решетку. Твердые вещества с атомной связью, состоящие из атомов, имеют атомную решетку.
Ионная связь - химическая связь, образованная в результате электрического притяжения двух разноименно заряженных ионов, Существует между металлами и неметаллами. Твердые вещества, построенные из ионов, называют ионными кристаллами.
Пространственное расположение ионных кристаллов образует ионную решетку.
Атомная связь с частично ионным характером - особая форма связи, переходная форма между атомной и ионной связью. Образуется в результате различной силы притяжения, связывающих электронов с ядрами связанных атомов. Молекулы с такой связью имеют значительную полярность. Молекула с такой связью образует диполь.
Координационная связь - особая форма атомной связи. Связывающая пара электронов предоставляется одной из реагирующих частиц.
Неметаллическая связь - химическая связь, образующаяся в результате электрического притяжения между ионами металла и свободными электронами. Наличие свободных электронов определяет электропроводность металла. Ионы металла расположены в металлической решетке.
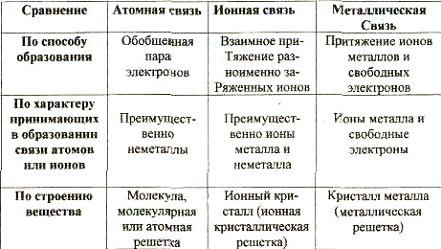 |
6.3. Сравнение характера химической связи.
6.4. Валентность и степень окисления
Стехиометрическая валентность - число, показывающее, сколько атомов водорода может связать или заместить в соединении атом данного элемента.
Степень окисления (окислительное число) - знак и величина заряда свободных элементов или элементов в их соединениях, если при этом каждую частицу элемента условно представить в виде иона, Условия, принятые для определения степени окисления.
|
Условие |
Пример |
|
|
Свободные элементы |
степень окисления = ±0 |
о о Сu Cl2 |
|
Элементы всоединении металлы водород кислород |
степень окисления = валентность степень окисления= +1 степень окисления= -2 |
+2 -2 Сu O +1 Н2 -2 O |
|
Простые ионы |
степень окисления = электрический заряд |
+1 -1 Na+ ,Br' |
|
Составные ионы |
сумма степеней окисления = электрический заряд |
-3 +1 N H4 |
|
Молекулы соединений |
сумма степеней окисления всех элементов = 0 |
+4 -2 С O2 |
|
Электрически ней тральные атомные группировки органических соединении |
сумма степеней окисления всех элементов = 0 |
-3 +1 С Нз |
 |
Тема 7. Окислительно-восстановительные реакции
7.1. Концептуальная диаграмма
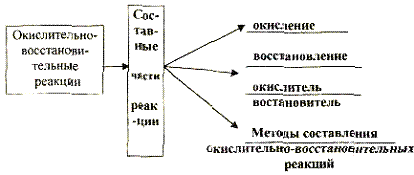
7.2. Реакции, в которых меняется степень окисления, называются окислительно-восстановительными.
Процесс отдачи электронов называют окислением, а принятие -восстановлением.
Атом или ион, который отдает электрон окисляется и одновременно является восстановителем. Атом или ион, принимающий электроны, восстанавливается и одновременно является окислителем. Окисление и восстановление - это две стороны одного и того же процесса. Они протекают одновременно и не могут существовать независимо друг от друга.
В химических реакциях число отданных электронов равно числу принятых. Число положительных зарядов в ядре всегда остается неизменным.
7.3. Для того, чтобы правильно составить уравнение окислительно-восстановительной реакции, нужно прежде всего знать, какие продукты образуются в результате этой реакции. Это во многом зависит от среды, в которых реакция протекает, свойств реагирующих веществ и некоторых других условий. После того, как продукты реакции определены, в уравнении реакции следует расставить коэффициенты.
Рассмотрим как определять степень окисления элементов в соединении, например степень окисления азота в азотной кислоте HNO3 Исходим из того, что степень окисления водорода+ 1, кислорода -2. В целом молекула должна быть электронейтральна, т.е. ее заряд равен нулю.
Обозначим искомую степень окисления азота х, тогда Н+1NxO22. Составляют уравнение + 1+ х+ (-2) 2=0, отсюда х=+ 3, т.е. степень окисления азота в азотной кислоте равна+ 3.
Если схематически обозначить связь степени окисления с окислительно-восстановительными процессами, то схема будет выглядеть следующим образом:
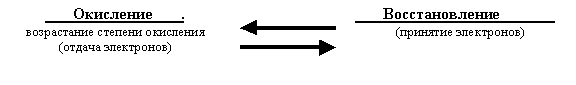 |
7.4. Составление уравнений окислительно-восстановительных реакций
Рассмотрим схему реакции
Н2S0з + Br2® H2S04 + НВr
7.4.1. Прежде всего, необходимо над каждым элементом расставить степень окисления
7.4.2. Находим элементы, меняющие степень окисления
7.4.3. Выясняем, какой элемент является окислителем, какой восстановителем и как меняется степень окисления.
Атом серы имел степень окисления +4, после реакции его степень окисления стала +6. Это означает, что атом серы со степенью окисления +4 отдал 2 электрона и приобрел заряд +6, т.е. сера является восстановителем:
Атом брома принял 1 электрон и из нейтрального превратился в отрицательно заряженный ион со степенью окисления-1:
Бром является окислителем. Но поскольку молекула брома состоит из 2 атомов и электроны принимаются обоими атомами
 |
Учитывая отдачу и прием электронов, получим:
Число отданных электронов должно быть равно числу принятых. Это называется электронным балансом ("баланс равновесие).
Если реакция протекает в растворе, то это учитывается следующим образом
7.5. Электронно-ионный метод составления окислительно-восстановительных реакций
Электронно-ионный метод расстановки коэффициентов в окислительно-восстановительных реакциях применяется наряду с методом электронного баланса для реакций, протекающих в растворах.
Степень окисления при этом способе определять не нужно, т.к. рассматривается участие в реакции не отдельного атома, а целого реального иона. Электронно-ионный метод правильнее отражает реальные процессы, протекающие при окислительно-восстановительных реакциях в растворе.
При составлении уравнений обязательно учитывается участие молекул воды, кроме того, важно, в какой среде происходит реакция.
При этом нужно помнить следующее:
1) в ионной форме записываются только формулы веществ, распадающихся в растворе на ионы;
2) во всех случаях сначала уравнивается число кислородных атомов;
3) в кислой среде кислород отдают молекуле воды, а связывается он ионами водорода.
При составлении уравнений в щелочной среде правила те же, но кислород представляют ионы ОН- , а связывается он молекулами воды,
В нейтральной среде добавление и связывание атомов кислорода осуществляется только молекулами воды.
Тема 8. Металлы
8.1. Металлические элементы и вещества. Систематика металлов.
В химии названием металл обозначают, с одной стороны, металлические элементы и, с другой стороны, элементарные вещества, обладающие характерными для металлов признаками.
Характерным признаком металлических элементов является способность их атомов образовывать элементарные положительные ионы и с окислительными элементами давать прочные соединения - соли.
Основой классификации металлических элементов является периодическая система. Металлическими элементами начинается каждый период и число их возрастает с увеличением номера периода. Металлические элементы по значениям максимальной валентности, формам и свойствам главных соединений подразделяются на группы, соответствующие группам периодической системы. Элементы, составляющие IA группу периодической системы, называются щелочными металлами, элементы, составляющие ПА группу (кроме бериллия), - щелочноземельными металлами. В остальных группах название дается по первому элементу ~ группа скандия, титана, ванадия и др.
В узлах кристаллической решетки металлов располагаются положительные ионы, а между ними, перемещающими по всему объему металла, свободные электроны, Металлическая связь проявляется за счет обобществления внешних электронов и является одним из видов химической связи. Она отличается от ковалентной, в которой обобществляются электроны лишь двух соседних атомов, тем, что в обобществлении принимает участие совокупность электронов всех атомов металла.
8.2. Физические свойства металлов
8.2.1. Агрегатные состояния и полиморфизм
Металлы (кроме ртути) могут находиться в трех агрегатных состояниях - твердом, жидком, парообразном.
Для каждого металла можно определить три области температуры, характеризующих агрегатное состояние: 1) при температурах ниже температуры плавления и опредленном давлении металл устойчив в твердом и равновесном с ним парообразном состоянии; 2) в интервале от температуры плавления до критической температуры при определенном давлении металл устойчив в жидком и равновесном с ним парообразном состоянии; 3) выше критической температуры металл существует только в газообразном состоянии при любом давлении.
Равновесие между парообразным металлом, с одной стороны, и твердым или жидким - с другой, характеризуется величиной давления пара Р и ее зависимостью от температуры Т:
Lg Р = А - В/Т, где А и В - коэффициенты, постоянные для данного металла в определённом состоянии.
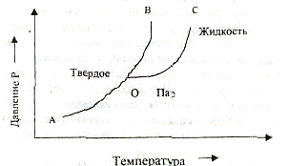 |
На рис. 8.1. показана диаграмма состояния, типичная для большинства металлов.
Рис. 8.1. Диаграмма состояния металлов
На ней отмечены области существования твердой, жидкой и парообразной фаз в зависимости от Т и Р. Точка О - тройная точка, соответствующая температуре равновесия твердой и жидкой фаз при давлении, равном давлению их пара (температура плавления). Кривая 0В показывает зависимость температуры плавления от давления.
Многие металлы в твердом состоянии способны принимать различные кристаллические формы. Это явление, называемое полиморфизмом, заключается в том, что одно и то же вещество в зависимости от условий кристаллизации образует кристаллы различной формы. Каждой полиморфной модификации металла свойственны определенное давление пара и зависимость его от температуры.
Полиморфную модификацию, устойчивую при сравнительно низких температурах, обозначают буквой а перед названием или символом, а модификацию, устойчивую при более высоких температурах буквой р,
8.2.2. Механическое свойство металлов
Характерным механическим свойством металлов является пластичность. Под пластичностью понимают способность тел при действии внешних сил подвергаться деформации, которая остается и после прекращения этого действия. Пластичность металлов обусловлена тем, что при внешнем воздействии слои ионов, образующие кристаллическую решетку, сдвигаются относительно друг друга без разрыва, т.к. переместившиеся электроны продолжают осуществлять связь между ионными слоями,
8.2.3. Тепловые свойства металлов
Подавляющее большинство металлов характеризуется малыми значениями удельной теплоёмкости (меньше 0.84 дж/г.град).
Важной характеристикой металлов является теплота сублимации, выражаемая величиной энергии, необходимой для перевода в парообразное состояние определенной массы металла. Эта величина является мерой прочности связи в кристаллической решетке твердого тела. Теплота сублимации меняется от 72,8 (Fr) до 836,8 (W) кдж/г ат.
Для металлов характерна большая теплопроводность. За передачу тепла через металл в основном ответственны свободные электроны, которых в единице объема металла весьма велико (5 1027 м-3).
8.3. Химические свойства металлов
8.3.1. Восстановительная способность металлов
Химические свойства металлов обусловлены характерной способностью атомов металлических элементов образовать элементарные положительно заряженные ионы, отдавая свои валентные электроны.
Восстановительная способность металлов связана с величиной энергии ионизации их атомов. Наименьшие значения ионизационного потенциала у щелочных металлов, которые являются самыми энергичными восстановителями.
Металлы вступают в реакции взаимодействия с различными окислителями, в качестве которых могут выступать элементарные вещества, кислоты, соли менее активных металлов и др.
8.3.2. Химический характер соединений металлов
Наибольшей прочностью обладают соединения активных металлических с активными окислительными элементами. Такими соединениями являются простые соли. Они обладают сравнительно малой летучестью, высокой температурой плавления и способностью в расплавленном и растворенном состоянии диссоциировать на ионы,
Соединения мало активных металлических элементов напоминают кислотообразующие соединения, неспособные подвергаться электролитической диссоциации.
8.4. Электрохимические процессы
Химические процессы, которые сопровождаются возникновением электрического тока или, наоборот, сами вызываются им, называют электрохимическими.
8.4.1. Электродные потенциалы
Электродным потенциалом называют скачок потенциала, возникающий на границе металл-раствор электролита.
Металл в твердом состоянии представляет собой кристаллическую решетку, образованную ионами металла и свободными электронами.
Ионы металла, взаимодействуя с полярными молекулами воды, переходят в раствор. Электроны же остаются на поверхности металла, обусловливая его отрицательный заряд по отношению к раствору. Гидратированные ионы металла, испытывающие электростатическое притяжение отрицательно заряженного металла, концентрируются у его поверхности. В результате образуется двойной электрический слой.
Для неактивных металлов равновесная концентрация ионов металла в растворе очень мала. Если погрузить такой металл в раствор, то будет наблюдаться обратный процесс перехода ионов из раствора на металл. В этом случае поверхность металла получит положительный заряд, а раствор - отрицательный за счет остающегося в растворе избытка анионов.
Переход ионов металла в раствор сопровождается потерей электронов атомами металлов, т.е. является процессом окисления. Обратный процесс - превращение гидратированных ионов металла в атомы - процесс восстановления.
Равновесному состоянию реакции окисления - восстановления отвечает потенциал Еме, называемым электродным потенциалом. Величина Еме зависит от нескольких факторов и эта зависимость выражается формулой Нернста
Еме = Еме°+ (RT/nF) In [Men+m Н2О].
Здесь ЕMе - электродный потенциал металла в вольтах; EMe -стандартный потенциал при концентрации иона, равной единице;
R=8, 314 Дж /град; Т - температура; n - зарядность иона металла; F=96487 к; [Меn+ m Н2О] - концентрация ионов металла.
8.4.2. Химические источники тока и напряжений
Активность металлов, т.е. легкость отдачи ими электронов, сравнивается в реакциях вытеснения одних металлов другими из растворов их солей.
Рассмотрим, например, реакцию взаимодействия цинка с раствором медного купороса
Zn "- CuS04 - ZnS04+Cu
Процесс взаимодействия цинка с медью происходит в две стадии:
Zn = Zn2+-Ze" и Cu^ + 2е- - Cu
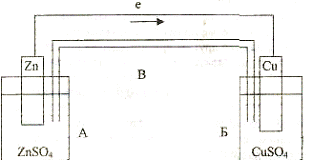 |
Очевидно, что передачу электронов можно осуществить не непосредственно, а через металлический провод. В этом случае по проводу от цинка к меди потек бы поток электронов т.е. электрический ток. Такая передача электронов осуществляется в гальваническом элементе, схема которого приведена на рисунке.
Схема гальванического элемента.
Сосуд А и соединяющая оба сосуда трубка В заполнены раствором ZnS04, сосуд Б - раствором CuS04. В первый из них опущена цинковая пластинка, во второй - медная.
Если соединить обе пластинки проводом е, то по нему в указанном стрелкой направлении потечет электрический ток.
Так как в цинке концентрация свободных электронов выше, чем в меди, то при соединении обоих электродов проводом некоторая часть электронов переходит по нему с цинка на медь, тем самым заряжая цинковую пластину положительно, а медную отрицательно.
Положительный заряд тотчас же нейтрализуется путем перехода в раствор положительных ионов цинка Zn2+ Тотчас же нейтрализуется и отрицательный заряд меди путем осаждения на электроде положительных ионов Си2+. Одновременно соответствующая часть ионов Zn2+ переходит по соединительной трубке В из сосуда А в сосуд Б, Все рассмотренные процессы непрерывно повторяются (до растворения всего цинка или полного разложения соли меди). Таким образом, в гальваническом элементе за счет химической реакции получается электрический ток.
Случай пары Zn - Сu не является исключением. Чем значительнее различие концентрации свободных электронов тем большее напряжение будет иметь электрический ток.
Зная знак заряда каждой из пластинок и измеряя напряжение тока, можно оценить сравнительную активность различных металлов и расположить их по этому признаку в так называемый ряд напряжений.
Это ряд имеет следующий вид:
... К ... Са . .. Mg. ,. Zn ... Fe ... Sn ... Н .. . Сu ... Ag . .. Au
Из этого ряда напряжений вытекают следующие следствия:
1. каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него;
2. все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее - не вытесняют;
3. чем дальше друг от друга расположены два металла, тем большее напряжение будет давать построенный из них гальванический элемент.
8.4.3. Коррозия металлов
Коррозия - это процесс разрушения металла под химическим воздействием соприкасающейся с ним среды, происходящей на по поверхности раздела фаз.
Коррозия представляет собой окислительно-восстановительный гетерогенный процесс, протекающий в газах, воздухе, в воде, в органических растворителях или в растворах электролитов. Различают химическую и электрохимическую коррозию металлов.
Химическая коррозия - это разрушение металла окислением его без возникновения электрического тока.
Разрушение металла в среде электролита с возникновением внутри системы электрического тока называется электрохимической коррозией. Практически любой металл содержит примеси других металлов. Поэтому в среде электролита система из основного металла и металла-примеси образует большое число микрогальванических элементов. Работа таких элементов может быть объяснена на основе величин стандартных электродных потенциалов. Если два разных металла соединить вне раствора проводником и поместить в раствор, содержащий их ионы, то более активный металл будет коррелировать, в то время как менее активный коррозии не подвергается.
8.4.4. Способы защиты от коррозии
Существует три способа защиты металлов от коррозии:
1. Изоляция металла от коррозийной среды.
А, покрытие корродирующего металла слоем другого металла, практически не коррелирующего в тех же условиях (Cr, Ni, Zn, Sn, Cd, Ag и др.)
Б- создание на поверхности металла слоя оксидов, например FeO, Fe2О3, Fe3О4 , Al2О3, либо нанесение пленок высокополимерных веществ (каучук, пластмасса), лака, олифы,
2. Электрохимические методы защиты (протекторная защита, электрозащита).
Для осуществления протекторной защиты используют специальный анод-протектор (например, старые железные детали, магниевые сллавы) с более отрицательным потенциалом, чем потенциал металла защищаемой конструкции. Если соединить проводником тока защищаемую конструкцию и протектор, то последний будет разрушаться и тем самым предохраняет от коррозии конструкцию.
3. Изменение свойств коррозийной среды. Вещества, способные при незначительных добавках их к коррозийной среде эффективно уменьшать коррозию металла или сплава, называются замедлителями (ингибиторами) коррозии. Чаще всего применяют такие замедлители коррозии, добавка которых к раствору электролита вызывает заметное изменение потеницала в этом растворе, приближая его к потенциалу малоактивных металлов.
Учебное издание План 1999 г. п. 16.4.
Ахмед Маллаевич Абдуллаев
Хайрулла Кабилович Арипов Зульфия Ержановна Агабекова Галина Николаевна Кузьмина Евгений Витальевич Объедков
ХИМИЯ
Конспект лекций
для бакалавров по направлению
В 522300 - Телекоммуникации (РРТ, ТУТ, ТТ ва КТ)
В 163600 - Педагог по телекоммуникации
В 522600 - Информатика и информационная технология
В 840500 - Почтовая служба
В 341100 - Менеджмент
В 522500 - Радиотехника
Часть 1
Рекомендовано к печати Редакционным советом ТЭИС
Утверждено к печати
Ташкентским электротехническим институтом связи (Протокол Учёного совета ТЭИС №10от 25,V. 2000 г.)
Отпечатано в ТЭИС зак. 4-I20-2001
Литература:
1. Электрорадиоматериалы/под ред. Тареева Б. М., -М.: Высшая школа, 1978.
2. Никулин Н. В,, Назаров А. С. Радиоматериалы и радикомпоненты М.;
Высшая школа, 1986.
3. Рычина Т. А., Электрорадиоэлементы, М,: Сов. радио, 1986.
4. Камолов Ш. М., Ахмедов А. Ш,, Электротехника материаллари. Т.:
Укитувчи 1994.
5. Касимов А.Х. Конспект лекции по химии, Т.: ТЭИС, 2000
6. Сборник лабораторных работ по дисциплине «Химия», Т.: ТЭИС, 2000
7. Волокобинский М.Ю. Химия, Санкт-Петербург, Петербургкомстат, 1998 г.
8. Яманов С. А. Химия и радиоматериалы, М.:Высшая школа, 1970.
9. Справочник во электротехническим материалам/под ред. Корницкого, 1974,75,76.
Тема 4 Неорганические соединения 4.1. Концептуальная диаграмма
4.2. Классификация неорганических соединений

Неорганическая химия изучает химические элементы и их соединения (кроме органических),
Все химические элементы традиционно делятся на металлы и неметаллы. К металлам относятся электроположительные элементы, способные сравнительно легко отдавать электроны, к неметаллам -электроотрицательные элементы, способные сравнительно легко присоединять электроны. Металлическое состояние характеризуется высокой электрической проводимостью, уменьшающейся с повышением температуры. В изолирующем (диэлектрическом) или полупроводниковом состоянии вещества имеют сравнительно низкую электрическую проводимость.
Неорганические соединения классифицируют по функциональному назначению и по составу. По функциональному признаку различают следующие типы: оксиды, гидроксиды, кислоты, соли.
Оксидами называются химические соединения, состоящие из двух элементов, один из которых кислород в степени окисления -2. Под степенью окисления понимают заряд атома в соединении, если бы все связи в этом соединении были ионные, а электроны смещены к наиболее отрицательному элементу,
Основаниями называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов ионов металла, а в качестве анионов - только гидрокcид-ионов.
Обычно основания называют гидроксидами, а гидроксиды металлов главной подгруппы 1 группы называют в некоторых случаях едкими щелочами.
Кислотами называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов только ионов водорода, а в качестве анионов - кислотного остатка.
Кислоты бывают кислородосодержащие и бескислородные. Кроме этого, кислоты классифицируются по основности: одноосновные, двухосновные, многоосновные.
Солями называются электролиты, диссоциирующие в водных растворах с образованием катиона металла и аниона кислотного остатка,
Комплексные соли имеют наиболее сложную структуру. В центре комплексного соединения находится центральный атом, который называется комплексообразователем. Вблизи комплекса расположены лиганды и адденды. Число легандов равно координационному числу комплексообразрователя. Координационное число определяет ряд факторов:
размер атома, масса его ядра, строение электронной оболочки и др.
Вместе с центральным атомом лиганды образуют внутреннюю среду комплексов. Роль лигандов могут играть и нейтральные молекулы.
Вместе с центральным атомом лиганды образуют внешнюю сферу комплекса. Дальше от комплексообразователя может размещаться внешняя сфера. Суммарный заряд внешней сферы всегда равен по величине и противоположен по знаку суммарному заряду внутренней среды, формулу которой обычно заключают в скобки. В процессе диссоциации внутренняя сфера комплексной соли на ионы не распадается.
4.3. Номенклатура неорганических соединений
По номенклатурным правилам каждое вещество получает в соответствии с его формулой систематическое название, полностью отражающее его состав.
Общее правило - название соединения, состоящего из двух элементов, строится из названий каждого из них.
Первым называется элемент с большей электроотрицательностью, добавляя к латинской основе окончание - ид. Вторым называют (в родительном падеже) элемент с меньшей элекгроотрицательностью.
|
Название элемента |
Название элементов в соединении |
|
Фтор |
Фторид |
|
Хлор |
Хлорид |
|
Бром |
Бромид |
|
Кислород |
Оксид |
|
Сера |
Сульфид |
|
Азот |
Нитрид |
|
Углерод |
Карбид |
4.4. Химическая формула сложного вещества
Химическая формула сложного вещества включает в себя условно электроположительную составляющую или реальный катион и условно электроотрицательную составляющую или реальный анион. В формулах двухэлементных соединений из металлических и неметаллических элементов на первое место помещают металл.
Название сложного вещества согласно его формуле читается справа налево.
4.5. Взаимосвязь классов неорганических веществ
|
|
Неметалл || Кислотный || оксид |
Кислота |
Соль |
Вода |
|
|
Металл |
Соль, если О2-оксид |
|
Соль+ +водород |
Соль+ +металл |
Основание или основ-ной оксид + водород |
|
Основной оксид |
- |
Соль |
Соль+ +вода |
- |
Основание |
|
Основание |
- |
Соль+вода |
Соль+ +вода |
Соль+ основание |
- |
|
Соль |
- |
- |
Соль+ +кислота |
Соль+ соль |
Продукты гидролиза |
|
Вода |
- |
кислота |
- |
Продукты гидролиза |
- |
Тема 5 Строение атома. Периодический закон и строение атома.
5.1. Протоны, нейтроны и электроны в атоме
Атом является сложной системой, состоящей из положительно заряженного ядра и движущихся электронов, составляющих в совокупности его электронную оболочку,
Ядро атома состоит из протонов и нейтронов. Число протонов в ядре определяет величину положительного заряда ядра, чему соответствует порядковый номер элемента Z. Массовое число А отвечает суммарному числу протонов и нейтронов.
Природа элемента определяется числом протонов в ядре. Ядра всех атомов данного элемента имеют одно и то же число протонов, т.е. одинаковое значение Z. Разновидности элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов, т.е. характеризующиеся различными массовыми числами, но одинаковым порядковым номером, называются изогонами. С открытием изотопов было по-новому сформулированно понятие химического элемента. Химическим элементом называется вид атомов, обладающих одинаковым зарядом ядра.
Изотопы различных элементов с различными порядковыми номерами, но одинаковыми массовыми числами, называются изобарами. Изобары отличаются числом протонов и нейтронов в ядре, хотя общее число нуклонов у них одинаково. Изобары различны по своей химической природе.
5.2. Квантовая теория строения атома (теория атома Бора).
В основе теории строения атома лежат три постулата Бора.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные квантовые состояния, не изменяющиеся без внешних воздействий на атом.
В этих состояниях электрон, не излучая энергию, движется по круговым орбитам.
Второй постулат Бора (правило частот): при переходе атома из одною стационарного состояния в другое испускается или поглощается один фотон. Энергия фотона равна разности энергий атома в двух его стационарных состояниях:
![]()
Третий постулат Бора (правило квантования орбит): в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса (момента количества движения)
![]()
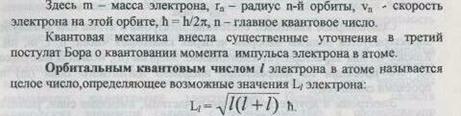
Орбитальное квантовое число 1] не совпадает с главным квантовым числом п. При заданом п орбитальное квантовое число может принимать следующие значения:

Вектор li момента импульса электрона не может иметь произвольную ориентации в пространстве. Ориентация вектора L; во внешнем магнитном поле с индукцией В характеризуется проекцией L,® вектора L; на направление вектора В
![]()

Для объяснения всей совокупности энергетических уровней водородоподобных атомов была введена гипотеза о наличии собственного
вращения электрона.
Величина момента количества вижения
5.2. Периодическая система элементов Менделеева
Периодической системой элементов Меделеева называется закон периодического изменения химических и физических свойств элементов в зависимости от их атомного номера Z. Через промежутки, называемые периодами в системе Менделеева, элементы, расположенные в одном вертикальном ряду (группе элементов), обнаруживают повторяемость физических и химических свойств.
Химические и физические свойства атомов химических элементов объясняются, главным образом, поведением электронов, расположенных во внешнем слое и внешней подоблочке атомов. Такие электроны называются валентными электронами. Периодичность свойств химических элементов связана с периодичностью в расположении валентных электронов атомов различных элементов данной группы.
Теория периодической системы элементов Менделеева основывается на четырех положениях:
а) общее число электронов в атоме данного химического элемента равно порядковому номеру Z этого элемента;
б) состояние элементов в атоме определяется полным набором четырех квантовых чисел: n, l, m, ms,
в) распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
г) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Заполнение электронами состояний в различных оболочках (слоях), а в пределах одной оболочки - в подгруппах (подоболочках) происходит в соответствии с требованием пункта в): сначала заполняют состояния с наименьшей возможной энергией, а затем состояния со все большей энергией. Для многих атомов этот порядок соответствует тому, что сначала заполняются оболочки с меньшим n, а затем оболочки с большим значением n. В пределах одной оболочки сначала заполняются состояния с l=0, а затем состояния с большими l, вплоть до l = n - 1. Заполнение оболочек и подоболочек по этому принципу должно соответствовать таблице 1.
В реальной периодической системе элементов Менделеева распределение электронов в атоме отличается от того, которое соответствует таблице 1. В результате взаимодействия между электронами при квантовых числах n = 3, 4,... состояние с большим n и малым / имеет меньшую энергию и является более выгодными энергетически, чем состояния с меньшим n, но с большим l Нарушения "идеального" заполнения состояний начинаются с калия (Z=19). Девятнадцатый электрон калия должен был бы занять состояние в М -оболочке при l = 3 и n = 2. Но химические свойства калия аналогичны свойствам лития и натрия, у которых валентный электрон занимает состояния соответственно n = 2, 1-0 и n = 3, 1-0. Поэтому и у калия его валентный девятнадцатый электрон должен находиться в s - состоянии (l = 0), Он занимает это состояние в следующей N - облочке (М =4). От калия (Z=19) до скандия (Z=21) при незаполненной d -оболочке (l = 2) в М-слое начинается "застройка" N - оболочки. Начиная со скандия, возобновляется заполнение подоболочки d в слое М, которое заканчивается у меди (Z = 29). Далее до криптона (Z=36) происходит нормальное заполнение N - оболочки.
В настоящее время периодическая система элементов Менделеева содержит химические элементы с атомными номерами от Z=1 (водород) до Z = 104 (курчатовий). Химические элементы с атомными номерами Z=105, Z=106, Z-I07 окончательно не названы.